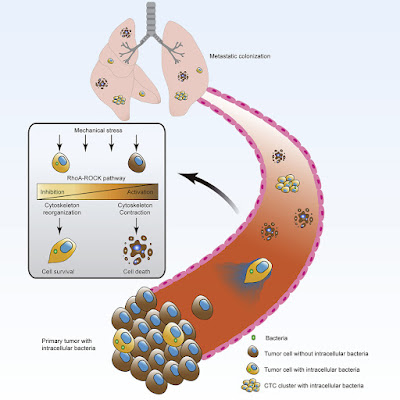
Le microbiote intracellulaire résident dans la tumeur est un composant tumoral émergent qui a été documenté pour une variété de types de cancer avec des fonctions biologiques peu claires. Ici, nous avons exploré la signification fonctionnelle de ces bactéries intratumorales, principalement en utilisant un modèle de tumeur mammaire spontanée murine MMTV-PyMT. Nous avons constaté que l'épuisement des bactéries intratumorales réduisait considérablement les métastases pulmonaires sans affecter la croissance tumorale primaire. Au cours de la colonisation métastatique, les bactéries intratumorales portées par les cellules tumorales circulantes ont favorisé la survie des cellules hôtes en améliorant la résistance au stress de cisaillement des fluides en réorganisant le cytosquelette d'actine. Nous avons en outre montré que l'administration intratumorale de souches bactériennes sélectionnées isolées du microbiote résident dans la tumeur favorisait la métastase dans deux modèles de tumeurs murines avec des niveaux significativement différents de potentiel de métastase. Nos résultats suggèrent que le microbiote résidant dans la tumeur, bien qu'à faible biomasse, joue un rôle important dans la promotion des métastases cancéreuses, dont l'intervention pourrait donc valoir la peine d'être explorée pour faire progresser les soins en oncologie. Aikun Fu, et al, dans Cell, publication en ligne en avant-première, 7 avril 2022
Source iconographique,
légendaire et rédactionnelle : Science
Direct / Préparation post : NZ